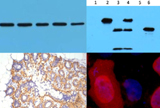
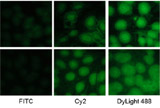
蛋白印跡(Western blotting,WB) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 發布時間:2011-04-30 21:38:57點擊次數: 作者: | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
蛋白印跡,也稱Western,Western blot、Western blotting、Western印跡,是檢測蛋白的重要方法之一。經過PAGE分離的蛋白質樣品,轉移到固相載體(例如硝酸纖維素薄膜)上,固相載體以非共價鍵形式吸附蛋白質,且能保持電泳分離的多肽類型及其生物學活性不變。以固相載體上的蛋白質或多肽作為抗原,與對應的抗體起免疫反應,再與酶或同位素標記的第二抗體起反應,經過底物顯色或放射自顯影以檢測電泳分離的特異性目的基因表達的蛋白成分。該技術也廣泛應用于檢測蛋白水平的表達。 (一) 蛋白樣品的制備 可以選用適當的裂解液,裂解貼壁細胞、懸浮細胞或組織樣品。對于某些特定的亞細胞組份蛋白,例如細胞核蛋白、細胞漿蛋白、線粒體蛋白等,可以參考相關文獻提取這些亞細胞組份蛋白,也可以使用試劑盒進行抽提。 為確保每個蛋白樣品的上樣量一致,收集的蛋白樣品均應測定其蛋白濃度。在微量離心管中,用2×SDS加樣緩沖液按1:1(v/v)稀釋待測蛋白質樣品,于 (二)SDS-PAGE電泳 1. SDS-PAGE凝膠配制 (1)取出玻璃板,用自來水洗凈后,蒸餾水沖洗一次,置37 度烘干或晾干(戴手套操作),梳子應用水洗凈,臨用前用乙醇擦拭,揮發至干。組裝電泳裝置中的玻璃平板夾層,并固定在灌膠支架上,確保不漏膠。 (2)按表1配制分離膠液體并脫氣,其中AP和TEMED灌膠前再加入,輕輕搖勻,以免產生氣泡。 表1 凝膠的制備
按所需分離的蛋白質分子大小配制合適濃度的凝膠(表2),將凝膠溶液平穩地注入兩層玻板中(以平穩流速從墊片的邊緣注入),緩慢持續注入至液面距梳齒2 表2 SDS-PAGE凝膠的有效分離范圍
(3)傾去頂層的異丁醇,并以1×Tris-Cl/SDS, pH8.8緩沖液沖洗凝膠的頂部表面,盡量用吸水紙吸干。按表1配制積層膠液體,以連續平穩的流速在分離膠上面注入濃縮膠液至玻板頂端,然后立即小心的插入梳子。必要時,再補加積層膠液體充盈剩余空間,室溫聚合30min。 2.上樣與電泳 (1)待濃縮膠完全聚合后,取下梳子,用1×SDS電泳緩沖液洗滌加樣槽,以除去未聚合的丙烯酰胺,然后取下夾子、以及環繞在玻板周圍的乳膠條,注意不要改變玻板的相對位置。 (3)用微量上樣器將同樣濃度的蛋白質樣品等體積加入到樣品孔中,小心加樣使樣品在孔的底部成一薄層。對于 (4)再往上槽加入余下的1×SDS電泳緩沖液。此操作緩慢小心,以防沖起樣品孔中的樣品。 (5)連接電源,電泳時通常在上層膠時使用低電壓恒壓電泳,而在溴酚藍進入下層膠時使用高電壓恒壓電泳。對于標準電泳裝置或類似電泳裝置,低電壓可以設置在80-100V,高電壓可設置在120V左右。采用普通的電泳儀就可以滿足SDS-PAGE電泳的要求,為方便起見,也可整個SDS-PAGE電泳過程均采用恒壓的方式,通常把電壓設置在100V,然后設定時間為90~120分鐘。設置定時可以避免經常發生的電泳過沖。 通常電泳時溴酚藍到達膠的底端處附近即可停止電泳,或根據預染蛋白質分子量標準的電泳情況,預計目的蛋白的電泳位置。(6)關閉電源并撤去連接的導線,棄去電泳緩沖液。連同上槽一起將凝膠夾層取出。卸下玻板,放在紙巾上,撬開玻板。緊靠最左邊一孔凝膠上部切除一角以標注凝膠的方位。 (三)轉膜——半干式轉移 在Western實驗中,常用的轉印膜有PVDF膜和硝酸纖維素膜(NC膜)(表3 )。PVDF膜特別注意的是需要100%甲醇預處理(不超過15秒)再用緩沖液平衡。在轉移槽的陽極板上按以下順序放置下物:浸過緩沖液的3張濾紙、膜、 凝膠、浸過緩沖液的3張濾紙,蓋上負極蓋,恒電流1.5-2 mA,電壓不要超過25伏通電1-2小時,膠中的蛋白質將轉移至膜上。120kDa以上高分子量蛋白質,用此法的轉移效率不高,可采用濕轉法。 轉膜時,具體的轉膜時間要根據目的蛋白的大小而定,目的蛋白的分子量越大,需要的轉膜時間越長,目的蛋白的分子量越小,需要的轉膜時間越短。轉膜效果可以通過預染蛋白質分子量標準觀察,也可以用麗春紅染色液對膜進行染色,以觀察實際的轉膜效果。或者用考馬斯亮藍染色液對轉膜后的PAGE膠進行染色,以觀察蛋白的殘留情況。膜可用免疫顯色法顯色,也可密閉于袋中置-20度保存。 表3 幾種膜的特點
(四)封閉 轉膜完畢后,立即把蛋白膜放置到預先準備好的PBST中,漂洗1-2分鐘,以洗去膜上的轉膜液。從轉膜完畢起,以后所有的步驟均要注意膜的保濕,避免膜的干燥,否則極易產生較高的背景。可用巴斯特吸管吸盡洗滌液,將膜放入雜交袋中,根據膜面積以0.1ml/cm2量加入WB封閉液,盡可能排盡氣泡,然后密閉袋口,在水平搖床上緩緩搖動,室溫封閉1-2小時。如背景較高,可以在 (五)一抗孵育 用封閉液將一抗適當稀釋(1:400-3000),將已封閉的膜置抗體溶液(溶液量根據膜面積以0.1ml/cm2計算)中,排盡氣泡,密閉袋口室溫緩緩搖動1-3小時或4度過夜。將膜轉移至淺托盤中,用漂洗液(PBST)振搖洗3-5次,每次5-10分鐘。 (六)二抗孵育 用封閉液將二抗1:200-2000稀釋,將膜置抗體溶液(溶液量根據濾膜面積以0.1ml/cm2計算)中,室溫緩緩搖動1-2小時。將膜轉移至淺托盤中,用漂洗液(PBST)振搖洗3-5次,每次5-10分鐘。 (七)蛋白檢測 目前常用的顯影方法有ECL化學發光法和DAB顯色法。具體使用細節可參考相關產品說明書。 (八)膜的重復利用 如果蛋白樣品非常寶貴,可以使用WB抗體去除液處理蛋白膜,以重復利用蛋白膜。 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 上一篇:染色質免疫沉淀技術(Chromatin Immunoprecipitation,ChIP) 下一篇:返回列表 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||